Zawartość
- Liczba elektronów w powłoce walencyjnej
- Krok 1
- Krok 2
- Krok 3
- Krok 4
- Struktura Lewisa
- Krok 1
- Krok 2
- Krok 3
- Formalny ładunek każdego atomu
- Krok 1
- Krok 2
- Krok 3
Określając ładunek formalny cząsteczki, takiej jak CoCl2 (gaz fosgen), należy znać liczbę elektronów w warstwie walencyjnej każdego atomu i strukturę Lewisa cząsteczki.
Liczba elektronów w powłoce walencyjnej
Krok 1
Poszukaj każdego atomu w układzie okresowym pierwiastków, aby określić liczbę elektronów w powłoce walencyjnej.
Krok 2
Pamiętaj, że dwa elektrony są na pierwszym podpoziomie s, dwa na drugim podpoziomie s, sześć elektronów na pierwszym podpoziomie p itd. Pamiętaj: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Krok 3
Uderz w ładunek. Jeśli cząsteczka jest jonem, dodaj lub odejmij jeden lub więcej elektronów od całości, aby uzyskać ostateczny ładunek.
Krok 4
Dla CoCl2 (gazowy fosgen): C = 4; O = 6; Cl = 7. Cząsteczka nie jest zjonizowana i ma ładunek obojętny. Dlatego całkowita liczba elektronów w powłoce walencyjnej wynosi 4 + 6 + (7x2) = 24.
Struktura Lewisa
Krok 1
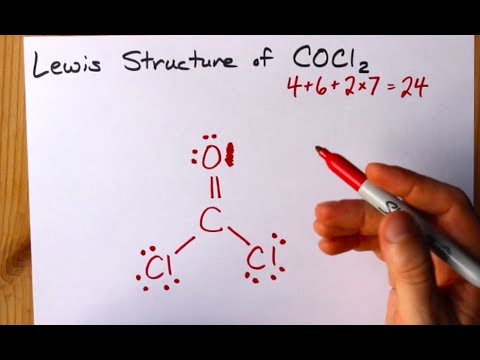
Zobacz schemat struktury Lewisa CoCl2 (gazowy fosgen). Struktura Lewisa reprezentuje najbardziej stabilną i prawdopodobną strukturę cząsteczki. Atomy są przyciągane przez sparowane elektrony walencyjne; wiązania są tworzone między swobodnymi elektronami, aby spełnić regułę oktetu.
Krok 2

Narysuj każdy atom i jego elektrony walencyjne, a następnie utwórz wiązania według potrzeb.
Krok 3
Atomy chlorków mają proste wiązania z cząsteczką węgla, podczas gdy atom tlenu tworzy podwójne wiązanie z węglem. Każdy atom w ostatecznej strukturze spełnia regułę oktetu i ma osiem elektronów w powłoce walencyjnej, co zapewnia stabilność molekularną.
Formalny ładunek każdego atomu
Krok 1
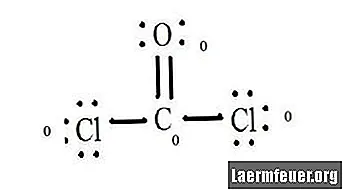
Policz wolne od elektronów pary każdego atomu w strukturze Lewisa. Każdy atom ma przypisany elektron z każdego wiązania, w którym uczestniczy. Dodaj te liczby. W CoCl2: C = 0 wolnych par plus 4 elektrony wiązań = 4 elektrony. O = 4 elektrony wolnych par plus 2 elektrony wiązań = 6 elektronów. Cl = 6 elektronów wolnych par plus jeden elektron z wiązania o C = 7 elektronów.
Krok 2
Odejmij liczbę elektronów w powłoce walencyjnej w niezwiązanym atomie. Wynikiem jest formalny ładunek dla każdego atomu. W CoCl2: C = 4 elektrony walencyjne (ev) w atomie niezwiązanym minus 4 elektrony określone w strukturze Lewisa (LS) = 0 ładunek formalny O = 6 ev - 6 LS = 0 ładunek formalny Cl = 7 ev - 7 LS = 0 ładunków formalnych
Krok 3
Pisząc, umieść te ładunki blisko atomów w strukturze Lewisa. Jeśli cząsteczka ma całkowity ładunek, umieść strukturę Lewisa w nawiasach z ładunkiem zapisanym na zewnątrz w prawym górnym rogu.