Zawartość

Substancje czynne osmotycznie, oprócz podstawowej roli w biologii, odgrywają ważną rolę w przyrodzie. Wiele systemów biologicznych wykorzystuje aktywność osmotyczną do dystrybucji składników odżywczych i magazynowania energii. Aby zdefiniować te substancje, konieczne jest zrozumienie właściwości roztworów.
Krok 1
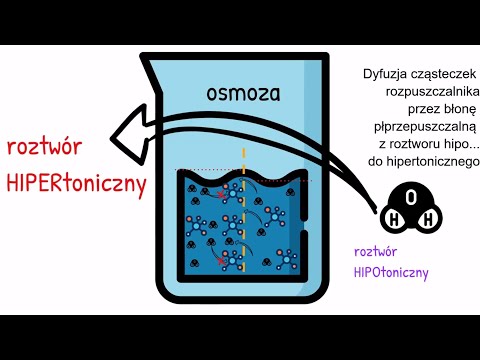
Zrozum znaczenie osmolarności. Osmolarność roztworu jest oparta na ilości substancji rozpuszczonej (pierwiastka rozpuszczonego) w stosunku do rozpuszczalnika (cieczy, w której rozpuszczona jest substancja rozpuszczona). Ilość substancji rozpuszczonej jest zwykle określana w molach. Mol to wartość oparta na wadze danej ilości substancji. Liczba moli substancji rozpuszczonej podzielona przez objętość (zwykle w litrach) rozpuszczalnika jest molarnością.
Krok 2
Określ względną osmolarność innego roztworu. Na przykład czysta woda destylowana z definicji nie ma osmolarności. Z drugiej strony, dwa różne roztwory o tej samej molarności nie będą miały między sobą żadnego potencjału osmotycznego. Roztwór, który jest osmotycznie aktywny w stosunku do innego roztworu, przenosi substancję rozpuszczoną lub rozpuszczalnik, aż obie substancje będą miały taką samą osmolarność.
Krok 3
Połącz swoje rozwiązania. Substancja czynna osmotycznie jest aktywna tylko wtedy, gdy istnieje możliwość wymiany substancji rozpuszczonej lub rozpuszczalnika między dwoma roztworami. Czasami pojawi się bariera, która blokuje to wystąpienie; takie bariery nazywane są nieprzepuszczalnymi.
Krok 4
Zrozumieć siłę osmotyczną. Aktywność osmotyczna może mieć kilka różnych sił napędowych. Najbardziej podstawową formą jest ta, która dąży do wyrównania stężenia substancji rozpuszczonej między dwoma rozpuszczalnikami. W innych sytuacjach substancja czynna osmotycznie jest wyzwalana nie tyle przez stężenie poszczególnych substancji rozpuszczonych, ile przez ich ładunki. Gdy istnieją substancje rozpuszczone z wieloma ładunkami, aktywność osmotyczna może powodować, że roztwory próbują zminimalizować ładunek netto, który ma każdy roztwór.
Krok 5
Użyj entropii. Osmoza jest naturalnym wynikiem procesu entropii, prawa fizycznego, które sugeruje, że wszystkie stany naturalne dążą do zaburzenia. W przypadku roztworów oznacza to, że cząsteczki substancji rozpuszczonej będą próbowały rozprowadzić się możliwie równomiernie między połączonymi roztworami.