Zawartość
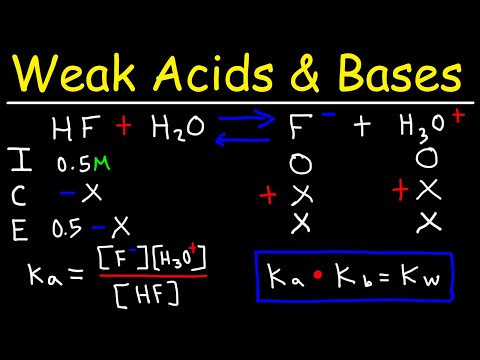
Różnica między silnym kwasem a słabym kwasem polega na tym, że silny kwas całkowicie jonizuje w roztworze, podczas gdy słaby kwas tylko częściowo. Skala pH odpowiada bezpośrednio ilości zjonizowanego wodoru w roztworze. W przypadku słabych kwasów pH zależy od stężenia roztworu. Jeśli znasz pH i rodzaj kwasu, możesz wydedukować stężenie i procent jonizacji. Ten typ obliczeń ma zasadnicze znaczenie dla nauki pracy z kwasami i zasadami.
Instrukcje

-
Oblicz stężenie jonów wodorowych o wzorze [H +] = 1 / (10 ^ pH), gdzie [H +] jest stężeniem jonów wodorowych. Ta formuła pochodzi z definicji pH: pH = - log [H +]. Na przykład, jeśli pH roztworu kwasu benzoesowego wynosi 2,51, [H +] = 1 / (10 2,51) = 3,09 x 10-3 moli / litr.
-
Poszukaj stałej dysocjacji kwasu (Ka) w tabeli słabego kwasu (patrz „Zasoby”). Z tabeli stała dysocjacji kwasu benzoesowego wynosi Ka = 6,46 x 10 -5.
-
Oblicz początkowe stężenie kwasu. Z definicji stałą dysocjacji jest Ka = [H +] [A -] / [HA], gdzie [HA] to stężenie początkowe, a [A-] to stężenie anionów kwasowych, które są jonami naładowanymi ujemnie. W stanie równowagi [HA] zmniejszy się o wartość równą [H +], a [H +] równa się [A-]. Zatem możesz napisać wyrażenie jako Ka = [H +] ² / ([HA] - [H +]). Rozwiąż dla [HA], aby uzyskać wzór [HA] = [H +] ² / Ka + [H +]. Na przykład: [HA] = (3,09 x 10 -3) ² / (6,46 x 10 -5) + (3,09 x 10-3) = 0,151 moli / litr.
-
Znajdź procent jonizacji o wzorze I = 100[H +] / [HA]. Na przykład I = 100(3,09 x 10-3) / 0,151 = 2,05%.