Zawartość
- Instrukcje
- Liczba elektronów w warstwie walencyjnej
- Struktura Lewisa
- Formalny ładunek każdego atomu
- Uwaga
- Czego potrzebujesz
Określając ładunek formalny cząsteczki, takiej jak CoCl2 (gaz fosgenowy), należy znać liczbę elektronów w warstwie walencyjnej każdego atomu i strukturę Lewisa cząsteczki.
Instrukcje

-
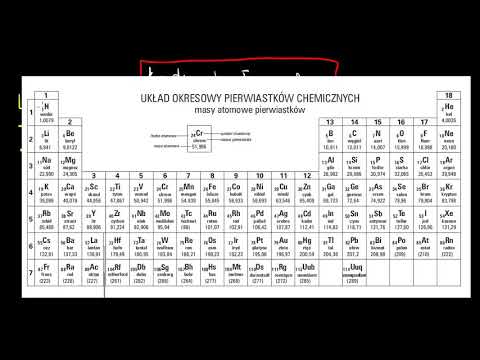
Poszukaj każdego atomu w układzie okresowym pierwiastków, aby określić liczbę elektronów w warstwie walencyjnej.
-
Przypomnijmy, że dwa elektrony znajdują się w pierwszym podpoziomie s, dwa są w drugim podpoziomie s, sześć elektronów w pierwszym podpoziomie p i tak dalej. Przypomnij: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Uderz ładunek. Jeśli cząsteczka jest jonem, dodaj lub odejmij jeden lub więcej elektronów z całości, aby osiągnąć ładunek końcowy.
-
Dla CoCl2 (gaz fosgenowy): C = 4; O = 6; Cl = 7. Cząsteczka nie jest zjonizowana i ma ładunek neutralny. Dlatego całkowita liczba elektronów w warstwie walencyjnej wynosi 4 + 6 + (7x2) = 24.
Liczba elektronów w warstwie walencyjnej
-
Zobacz schemat struktury Lewisa CoCl2 (gaz fosgenowy). Struktura Lewisa stanowi najbardziej stabilną i prawdopodobną strukturę cząsteczki. Atomy są rysowane za pomocą sparowanych elektronów walencyjnych; wiązania powstają między swobodnymi elektronami, aby spełnić regułę oktetu.
-
Narysuj każdy atom i jego elektrony walencyjne, a następnie w razie potrzeby utwórz wiązania.
Elektrony narysowane na strukturze Lewisa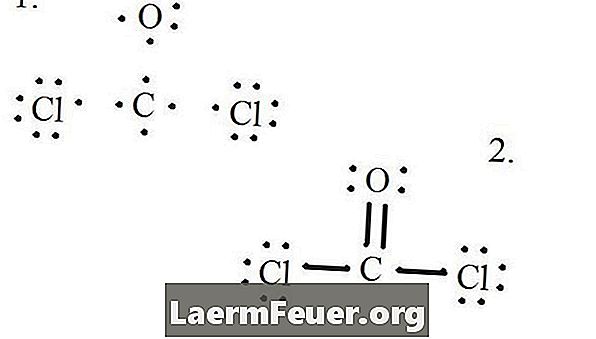
-
Atomy chloru dzielą pojedyncze wiązania z cząsteczką węgla, podczas gdy atom tlenu tworzy podwójne wiązanie z węglem. Każdy atom w końcowej strukturze spełnia regułę oktetu i ma osiem elektronów w warstwie walencyjnej, umożliwiając stabilność molekularną.
Struktura Lewisa
-
Policz pary wolnych elektronów każdego atomu w strukturze Lewisa. Każdy atom oznacza elektron każdej więzi, z której bierze udział. Dodaj te liczby. W CoCl2: C = 0 wolnych par plus 4 elektrony wiązań = 4 elektrony. O = 4 elektrony wolnych par plus 2 elektrony wiązań = 6 elektronów. Cl = 6 elektronów wolnych par plus jeden elektron jednego wiązania z C = 7 elektronów.
-
Odejmij ilość elektronów w warstwie walencyjnej od atomu niezwiązanego. Wynikiem jest formalny ładunek dla każdego atomu. W CoCl2: C = 4 elektrony walencyjne (ev) w niezwiązanym atomie minus 4 elektrony oznaczone w strukturze Lewisa (LS) = 0 ładunek formalny O = 6 ev - 6 LS = 0 ładunek formalny Cl = 7 i - 7 LS = 0 opłata formalna
Ładunki formalne atomów
-
Podczas pisania umieść te ładunki w pobliżu atomów w strukturze Lewisa. Jeśli w sumie cząsteczka ma ładunek, umieść strukturę Lewisa w nawiasach, z ładunkiem zapisanym na zewnątrz w prawym górnym rogu.
Formalny ładunek każdego atomu
Uwaga
- Obliczenie opłaty formalnej dla cząsteczek zawierających metale przejściowe może być zdradliwe. Liczba elektronów w warstwie walencyjnej dla metali przejściowych będzie taka jak dla wzorca gazu szlachetnego.
Czego potrzebujesz
- Układ okresowy pierwiastków